Masz rację w tej długości wiązania i dlatego siła wiązania wpływa na kwasowość (patrz: $ \ ce {H2S} $, $ \ mathrm {p} K_ \ mathrm {a} = 7 $ i $ \ ce { H2O} $, $ \ mathrm {p} K_ \ mathrm {a} = 15,7 $). Gdybyśmy zdefiniowali kwasowość za pomocą następującego równania
$$ \ ce {HX -> H + X} $$
, to siła wiązania byłaby rzeczywiście jedynym decydującym czynnikiem w kwasowości $ \ ce {HX} $, ponieważ zmiana entalpii tego procesu jest dosłownie energią dysocjacji wiązania.
Jednak kwasowość w rzeczywistości odpowiada heterolitycznej dysocjacji $ \ ce {HX} $ wiązanie, przy czym oba elektrony w wiązaniu zmierzają do $ \ ce {X} $:
$$ \ ce {HX -> H + + X -} $$
więc siła wiązania nie jest jedynym czynnikiem. W przypadku etanu, etenu i etyny najważniejszym czynnikiem jest rodzaj orbity, w której elektrony z wiązania $ \ ce {C-H} $ kończą się po deprotonowaniu. W przypadku etanu dwa elektrony trafiają na orbitę węgla $ \ mathrm {sp ^ 3} $; dla etenu, orbital $ \ mathrm {sp ^ 2} $; a dla ethyne orbital $ \ mathrm {sp} $.
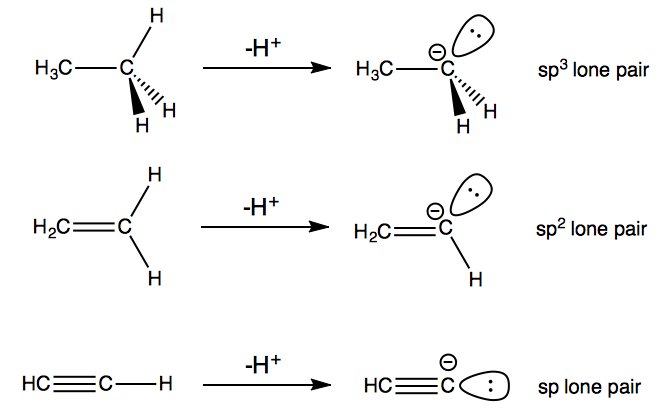
Teraz z tych trzech $ \ mathrm {sp } $ samotna para jest najbardziej stabilna , ponieważ orbital hybrydowy $ \ mathrm {sp} $ zawiera najwięcej znaków (50 $ \% $) i dlatego ma najniższą energię. Tak więc, z trzech karboanionów, samotna para w jonie acetylenowym $ \ ce {HC2 -} $ jest najbardziej ustabilizowana, czyniąc ethynę najbardziej kwaśną cząsteczką.
Kwasowość końcowych alkinów jest w rzeczywistości bardzo użyteczna z syntetycznego punktu widzenia, ponieważ można je deprotonować silną zasadą, taką jak $ \ ce {NaNH2} $, tworząc nukleofil oparty na węglu, który może być następnie użyty do tworzenia nowych wiązań $ \ ce {CC} $.
Jeśli chodzi o powody, dla których stabilizacja elektroniczna przeważa nad siłą wiązania, warto przyjrzeć się niektórym danym ilościowym. Obligacje $ \ ce {HO} $ i $ \ ce {HS} $ mają średnie entalpie obligacji odpowiednio 463 $ i 338 $ ~ \ mathrm {kJ ~ mol ^ {- 1}} $ (źródło: Physical Chemistry 9th ed., Atkins & de Paula, str 932), co stanowi różnicę $ \ mathbf {125 ~ kJ ~ mol ^ {- 1}} $. To może w pewnym stopniu wyjaśniać różnicę w kwasowości $ \ ce {H2O} $ i $ \ ce {H2S} $.
Z drugiej strony, energie dysocjacji $ \ ce { HC \ mathrm {(sp)}} $ i $ \ ce {HC \ mathrm {(sp ^ 2)}} $ obligacje są podane w J. Fiz. Chem. 1987 , 91 , 17-19 jako 132,6 $ i 116 $ ~ \ mathrm {kcal ~ mol ^ {- 1}} $ odpowiednio. Różnica wynosi około 17 $ ~ \ mathrm {kcal ~ mol ^ {- 1}} $, co odpowiada $ \ mathbf {69,5 ~ kJ ~ mol ^ {- 1}} $ - nieco niższej wartości niż wcześniej. Możesz zobaczyć, dlaczego wahania długości wiązań mogą więc odgrywać mniejszą rolę w węglowodorach.
Alternatywa
Inny równoważny sposób patrzenia na to jest taki, że $ \ mathrm { sp} $ - zhybrydyzowany węgiel jest bardziej elektroujemny niż zhybrydyzowany węgiel $ \ mathrm {sp ^ 2} $ -, który z kolei jest bardziej elektroujemny niż zhybrydyzowany węgiel $ \ mathrm {sp ^ 3} $.
Jak wspomniano wcześniej, orbital $ \ mathrm {sp} $ ma największy znak s, w związku z czym elektrony na orbicie węglowej $ \ mathrm {sp} $ doświadczają większego efektywnego ładunku jądrowego i są ściślej związane z jądrem niż elektrony w orbitali $ \ mathrm {sp ^ 2} $ lub $ \ mathrm {sp ^ 3} $.
Oczywiście wiązanie $ \ ce {CH} $ obejmuje również udział wodoru 1s orbital. Jednak powyższe oznacza, że elektrony w wiązaniach $ \ ce {C (sp) -H} $ są silniej przyciągane do jądra węgla niż elektrony w $ \ ce {C (sp ^ 2) -H} $ lub $ \ ce {C (sp ^ 3) -H} $ obligacje. Oznacza to, że wiązanie $ \ ce {C (sp) -H} $ jest bardziej spolaryzowane w kierunku węgla, pozostawiając mniejszą gęstość elektronów na wodorze i większą kwasowość.
Wielkość gęstości elektronowej w wodorze można w rzeczywistości zbadać za pomocą spektroskopii $ \ ce {^ 1H} $ NMR. Mniejsza gęstość elektronów przekłada się na większe przesunięcie chemiczne. Mimo że istnieje drugi, niezwiązany ze sobą czynnik - ekranowanie anizotropowe - który służy do zmniejszenia przesunięcia chemicznego wodorów acetylenowych, nadal pojawiają się one przy wyższych przesunięciach chemicznych niż wodory na węglowodorach nasyconych (~ 2 ppm, w porównaniu do ~ 1 ppm ). Jest to wyraźna wskazówka, że lokalna gęstość elektronów na protonie przyłączonym do $ \ ce {C (sp)} $ jest mniejsza niż na protonie przyłączonym do $ \ ce {(sp ^ 3)} $.