Jeśli ten związek może podlegać substytucji nukleofilowej, może to nastąpić tylko na drodze S N 1 , jako atak odwrotnej strony w przeciwdziałaniu wiązaniu $ \ ce {C -Br} Orbital $ jest zablokowany przez drugi przyczółek.
Często podaje się, że przyczółkowe kationy węgla nie są stabilne, to naprężenie. Samo napięcie jest pojęciem trudnym do uchwycenia i częściej zależy od tego, co wybierzesz jako system odniesienia. Jedynym celem jakościowym jest to, że kation jest bardziej naprężony niż nieskurczony kation trzeciorzędowy.
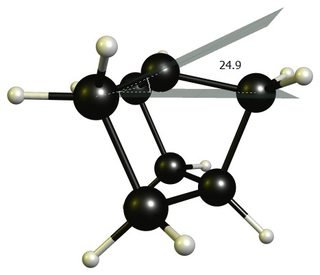
Innym często podawanym powodem jest to, że karbokation nie może przyjąć płaskiej struktury trygonalnej. Chociaż jest to technicznie prawdą, odchylenie od idealnego otoczenia trygonalnego jest dość małe; to tylko około 25 °. (DF-BP86 / def2-SVP)
Uważam, że przyczyna tej niestabilności jest nieco inna. W $ \ ce {C + (CH3) 3} $ wiązania wodorowęglowo-węglowe mogą dokładnie zrównać się z pustą orbitą p centralnego węgla. Stąd gęstość elektronów może zostać przeniesiona na tę orbitę lub z innego punktu widzenia ładunek dodatni może zostać zdelokalizowany do sąsiednich wiązań.
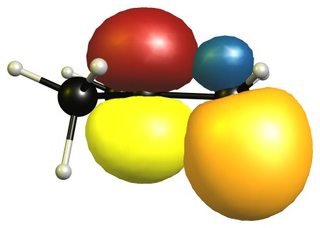
Powyższe jest tylko jedna przykładowa konfiguracja obliczona w DF-BP86 / def2-SVP. Nie jest to najniższa struktura, ale wybrana w celu pokazania zachodzenia na siebie hiperkoniugacji. Ponieważ cząsteczka nie jest w ogóle sztywna, a grupy metylowe obracają się, efekt stabilizujący będzie obecny przez większość czasu, w tej konformacji najłatwiej jest to zobaczyć.
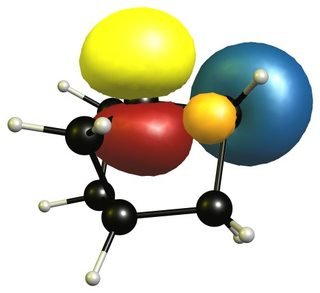
Ten efekt stabilizujący nie występuje w przypadku węgla wiązania wodorowe w pobliżu przyczółka. Te atomy wodoru w rzeczywistości wskazują na kationowe centrum, stąd ich nakładanie się nie jest w ogóle możliwe. Dlatego te obligacje nie mogą ustabilizować opłaty.
Istnieje jednak niewielka konfiguracja stabilizująca między wiązaniami węgiel-węgiel a niezajętą orbitą i to jest powód, dla którego karbokationy przyczółkowe stają się bardziej ustabilizowane dzięki większej strukturze pierścieni.
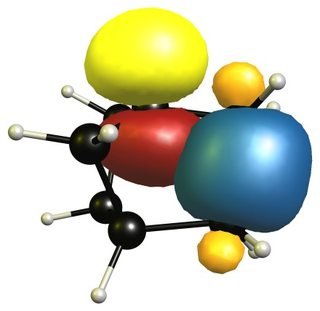
Jak zawsze, w grze występuje kilka różnych punktów, które pomagają ustabilizować pewne pozycje lub przestają to robić.
Przy odpowiedniej motywacji S N sub > 1 reakcja może być możliwa.
Kod koloru
Zajęte orbitale są wyświetlane w kolorze pomarańczowym i niebieskim, podczas gdy orbitale wirtualne są wyświetlane w kolorze czerwonym i żółtym. Fazy są wybierane losowo.