Sytuacja wiązania w złożeniu $ \ ce {(ICl3) 2} $ jest znacznie bardziej złożona niż to, co zostało przedstawione w tej książce. Sama cząsteczka ma bardzo wysoką symetrię, tj. $ D_ \ mathrm {2h} $, która musi być spełniona w opisie wiązania orbitalnego / walencyjnego. [1,2] Dlatego nie można rozróżnić pomiędzy mostkującymi wiązaniami chloru.
Analiza tej sytuacji wiązania w prostej koncepcji struktur Lewisa nie jest godna zaufania i doprowadzi do błędnych wniosków. Przeprowadziłem krótką optymalizację fazy gazowej na poziomie teorii DF-BP86 / def2-SVP i przeanalizowałem wynikową funkcję falową za pomocą teorii Natural Bond Orbital. Wydaje się, że kowalencyjne traktowanie któregokolwiek z wiązań jest niewłaściwe. W tym przypadku założyłem wszystkie pojedyncze obligacje. Ze względu na symetrię musimy zająć się tylko dwoma wiązaniami. Zewnętrzne wiązanie $ \ ce {I-Cl} $ jest spolaryzowane w 93% w kierunku chloru, ale zajęte tylko przez 1,25 elektronów. Pozostałe 0,75 elektronu można znaleźć na orbitali wolnej pary przeciwdziałającej wiązaniu. Nie jest to nawet bliskie oczekiwanemu zachowaniu struktury Lewisa. Wiązanie mostkujące $ \ ce {I- \ mu {} Cl} $ jest nadal w 81% spolaryzowane w kierunku chloru i zajmuje 1,92 elektronów. To tylko mówi nam, że to wiązanie ma wyższy charakter kowalencyjny.
Analiza za pomocą kwantowej teorii atomów w cząsteczkach (QTAIM) daje nam więcej narzędzi do analizy gęstości elektronów. Tutaj obraz jest dość oczywisty. Wszystkie wiązania w cząsteczce mają charakter silnie jonowy. Gęstość elektronów w punkcie krytycznym wiązania zewnętrznego $ \ ce {I-Cl} $ jest z 0,08 $ ~ \ mathrm {e \, a.u. ^ {- 3}} $ bardzo niska, a Laplacian jest w tym momencie dodatni. Gęstość elektronów w wiązaniu mostkującym jest jeszcze niższa i wynosi 0,04 $ ~ \ mathrm {e \, au ^ {- 3}} $, ponownie z dodatnim Laplacianem.
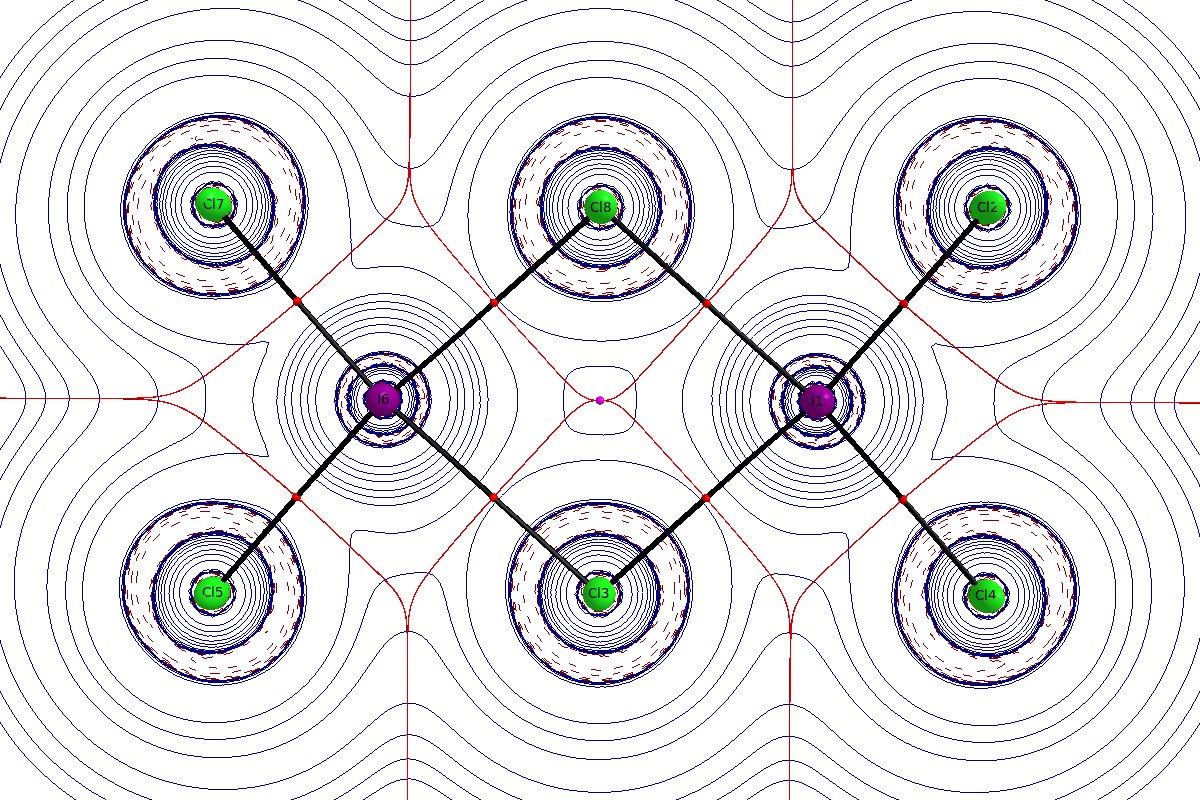
(Rozkład laplaciański, ciągłe niebieskie linie wskazują na zubożenie ładunku $ ∇ ^ 2ρ<0 $, przerywane niebieskie linie wskazują akumulację ładunku $ ∇ ^ 2ρ>0 $, czerwone kule to punkty krytyczne wiązania, różowe kule to punkty krytyczne pierścienia, czarne linie to ścieżki wiązania, ciemnoczerwona linie to powierzchnie o zerowym strumieniu.)
To odkrycie jest dość zgodne z obserwacją, że stop $ \ ce {(ICl3) 2} $ przewodzi prąd, który według Wikipedia jest wskazówką dotyczącą częściowej dysocjacji jonowej. $$ \ ce {(ICl3) 2 < = > ICl2 + + ICl4-} $$
Jednak płaskość tego związku w stanie stałym można przypisać możliwość posiadania dość rozległego systemu wiązań pi jako części małego wiązania kowalencyjnego. Dla ostatecznych wniosków na ten temat wyniki nie są wystarczające.
To, co można powiedzieć, sądząc z orbitali molekularnych $ \ ce {(ICl3) 2} $, jest takie, że poza zajętym rdzeniem d- orbitale jodu, żadne inne orbitale d nie są zaangażowane w żadne wiązanie - tak jak się oczekuje. Tutaj pokazane są zajęte orbitale niezwiązane z rdzeniem $ \ ce {(ICl3) 2} $. Warto zauważyć, że HOMO jest całkowicie przeciwne. [3]

Na koniec krótkie ostrzeżenie:
Chociaż założenie VSEPR może prowadzić do w przybliżeniu poprawnego wniosku dla związków międzyhalogenkowych $ \ ce {XF3} $, gdzie $ \ ce {X $ = $ Cl, Br, I} $, że cząsteczki są T w kształcie, jest to niewątpliwie właściwy wniosek dla znacznie mniej elektroujemnego chloru. Można to głównie wyjaśnić regułą Benta. Nawet w przypadku związku monomerycznego sytuacja wiązania jest nieco bardziej skomplikowana niż można by się spodziewać.
Uwagi i odniesienia
- Grupa punktów $ D_ \ mathrm {2h} $ określa, że istnieje główna oś symetrii $ C_2 $, która przechodzi przez środek pierścienia. Dodatkowo istnieją również dwie osie $ C_2 $ prostopadłe do tego i pozioma płaszczyzna lustra $ \ sigma_ \ mathrm {h} $. Oznacza to, że cząsteczka jest płaska. Istnieją również niepłaskie cząsteczki, które można opisać za pomocą tej grupy punktów.)
- Jak zauważył Max (dziękuję), struktura jest zaczerpnięta ze stanu stałego. K. H. Boswijk i E. H. Wiebenga, Acta Cryst. 1954, 7, 417-423. Wspomina, że został oczyszczony przez sublimację. Nie jest to absolutny dowód na istnienie gazowego dimeru, ale przynajmniej bardzo sugestywny. Dla naszych celów zakładamy, że obliczenia fazy gazowej są wystarczające.
- Orbitale uzyskane na poziomie teorii DF-BP86 / def2-SVP z Gaussian09 rev. D. Energia wzrasta w rzędach od lewej do prawej i od góry do dołu. Ostatnia pokazana struktura to sama cząsteczka.
Źródło: Sharma, RK Nieorganiczne Mechanizmy reakcji; Discovery Publishing House: 2007.