Wyjaśnienie atomowej struktury orbitalnej atomu to fascynująca historia. Właśnie został rozwiązany w ciągu ostatnich stu lat. Nie była to podróż liniowa, ale podróż pełna różnego rodzaju ślepych zaułków i pobocznych wycieczek. Grecy myśleli, że pierwiastki to powietrze, ogień, woda i ziemia. Nie rozumiejąc atomu, alchemicy spędzili miliony godzin i niezliczoną ilość pieniędzy, próbując zamienić inne substancje w złoto.
Tak więc pierwszy znaczący krok w rozwiązaniu struktury atomowej rozpoczyna się od Dmitrija Mendelejewa, któremu przypisuje się pojęcie układu okresowego. Pozwoliło to na odkrycie dodatkowych elementów, które były potrzebne do uzupełnienia tabeli. Nie wiadomo jednak, dlaczego układ stołu się sprawdził.
Mniej więcej w tym samym czasie trwały inne prace. Maxwell stworzył swoje słynne równania łączące prąd elektryczny i magnetyzm.
Odkrycie elektronu nastąpiło mniej więcej w tym samym czasie. Ale dopiero około 1900 roku zrozumienie elektronu było dość kompletne.
Fizycy wciąż nie rozumieli, jak złożyć atom. W tym momencie pojawiło się wiele modeli atomowych, aby wyjaśnić różne zjawiska. Jednym z takich modeli był model budyniu z ołowiu. Pomysł był taki, że atom był jak grudka budyniu, w której elektrony były zawieszone jak śliwki w budyniu.
Jeden wielki przełom nastąpił po Rutherford rozpraszaniu około 1910 roku. Eksperymenty te wykazały, że jądro (ładunek dodatni) znajduje się w środku atomu i ma bardzo małą objętość w porównaniu z całym atomem. Doprowadziło to do planetarnego modelu atomu. Ujemnie naładowane elektrony krążą wokół dodatnio naładowanego jądra, podobnie jak planety krążące wokół Słońca.
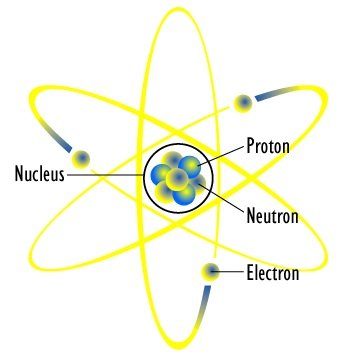
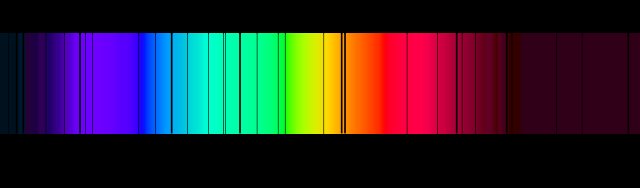
To nie wyjaśnia innych zjawisk, które były znane, jak widma liniowe wodoru, które odkrył Balmer przed 1900.

Takie widma liniowe były powiązane za pomocą wzoru Rydberga, który wiązał zasadę liczby kwantowej $ n $ ze strukturą atomową.
$ \ frac {1} {\ lambda} = R (\ frac {1} {{n_1} ^ 2} - \ frac {1} {{n_2} ^ 2}) $
w 1913 roku opracowano model Bohra. To wyjaśniało, że elektrony były ułożone w powłokach, a wypełnienie struktury powłoki można było powiązać z układem okresowym!
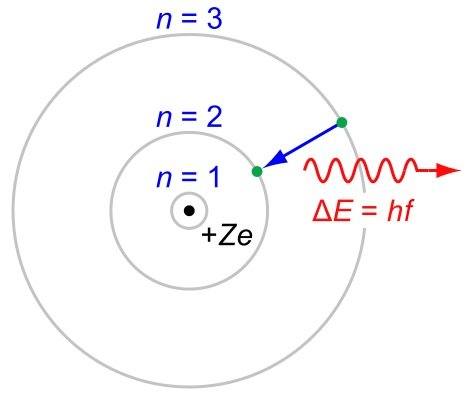
Struktura powłoki jest w zasadzie przyczepiona do modelu planetarnego przez Arnolda Sommerfelda i założono, że z jakiegokolwiek powodu elektrony nie mogą krążą wokół jądra atomu na „dowolnej” orbicie, ale musiały zajmować pewne orbity, które stały się znane jako powłoki. Do modelu Bohra dodano podpowłoki ($ l $, $ m $ i $ s $), aby sfałszować dodatkowe orbity w celu wyjaśnienia subtelnej struktury spektroskopowej niektórych pierwiastków. Podobnie jak linie Fraunhofera obserwowane w widmach słońca.
W tym momencie fizycy i chemicy skatalogowali większość zachowań atomów, ale nadal nie mieli pełnego zrozumienia, w jaki sposób atomy pracował.
W połowie lat dwudziestych Schrödinger opracował swoje słynne równanie, które dopełniło zagadkę struktury atomów na bardziej podstawowe elektrony i jądro. Z modelu Bohra wynika, że elektrony muszą znajdować się na pewnych orbitach, ponieważ orbity są skwantowane. Oznacza to, że każdy orbital ma określoną energię. Schrödinger pokazał, że orbity nie przypominały pasów podczas zdarzenia lekkoatletycznego, które ograniczało elektrony, ale że orbita elektronów była rozłożona w chmurze 3D wokół atomu. Innym aspektem prac Schrödingera i innych było to, że elektron miał zarówno charakterystykę falową, jak i charakterystykę cząstek.
Korzystając z równania fali Schrödingera, można obliczyć kształt orbitali. To było w 1930 roku, komputery wciąż były od dekad. Więc te obliczenia zostały wykonane ręcznie! „Problem” polegał na tym, że rozwiązanie równań było możliwe tylko dla jednego elektronu. Korzystając z rachunku różniczkowego, dobrze jest móc rozwiązywać równania, aby można było łatwo obliczyć całki. Jednak problem trzech ciał nie pozwala na takie rozwiązanie. Przy nowoczesnych komputerach można obliczyć rozwiązania numeryczne, mimo że całki nie istnieją.
Wracając do pytania. Orbital to funkcja matematyczna opisująca trójwymiarową ścieżkę elektronu wokół jądra. Zamiast planetarnej „orbity” orbital jest funkcją prawdopodobieństwa. Gęstość orbity zmienia się w zależności od promienia. W zależności od orbity funkcja prawdopodobieństwa wskazuje również orientację w przestrzeni 3D. Tak więc orbital S jest kulisty, tak jak w przypadku braku preferencji X-Y-Z. orbitale P mają jednak nie tylko aspekt promieniowy, ale także orientacje przestrzenne. Zatem trzy orbitale P są jak trójwymiarowe obroty dwulistnej róży w przestrzeni 2D. Tak więc orbitale P mają płaty zorientowane wzdłuż osi +/- X, osi +/- y i osi +/- z.
Słowo ostrzeżenia. Reprezentacje orbity są bardzo przydatne do przewidywania zachowania chemicznego, ale nie są „rzeczywiste”. To oczywiście robi się trochę szalone, gdy powstają cztery orbitale molekularne $ sp ^ 3 $, z których każdy ma znak 25% S i 75% P! To trochę tak, jakby myśleć, że jednorożec to hybryda konia i nosorożca.