Zwróciłem już na to uwagę w komentarzach, ale uważam, że nadszedł czas, aby to przemyśleć i wyjaśnić. Najpierw zajmijmy się pewnymi kwestiami koncepcyjnymi.
Hybrydyzacja to model, który może być użyty do opisania sytuacji wiązania. Nigdy nie jest przyczyną określonego układu geometrycznego, zawsze jest wynik porozumienia wiążącego. Ściśle mówiąc, nie jest nawet konieczne wywoływanie go, ale może być całkiem przydatne. Cytując z odpowiedzi Adityi - nie mogłem tego lepiej wyrazić:
Po pierwsze, „hybrydyzacja” jest pojęciem hipotetycznym, tj. Orbitale tak naprawdę nie mieszają się z tworzą nowe orbitale, ale „hybrydyzacje” są bardzo skuteczne w wyjaśnianiu budowy cząsteczek i ich właściwości fizycznych. Wiedząc, że związek ma hybrydyzację $ \ ce {sp ^ 2} $, po prostu pomoże ci uporządkować atomy składowe wokół centralnego atomu. Fizycznie nie ma to żadnego innego znaczenia.
Uwaga: tylko orbitale mogą być hybrydyzowane, a nie złożone.
Po zrozumieniu tego łatwo zauważyć, że atomy w cząsteczce mogą wykorzystywać wiele różnych schematów hybrydyzacji. Istnieją pewne koncepcje oparte na obliczeniach chemii kwantowej, które pozwoliłyby znaleźć najbardziej odpowiednie dopasowanie między strukturą Lewisa a podejściem do orbity molekularnej. Zobacz na przykład to piękne pytanie: Do czego służy teoria orbitalnych wiązań naturalnych? Istnieje również podejście bardziej ilościowe, nazywane teorią Wiązania Walencyjnego, ale wykracza to poza zakres odpowiedzi.
Ponieważ jest to tylko pojęcie matematyczne, równowaga między $ \ ce {sp ^ 2} $ a $ \ ce {sp ^ 3} $ niczego nie zmieni. Możemy zdecydować, w jaki sposób chcemy na to spojrzeć. W konsekwencji Ron postawił pytanie w komentarzach:
Nie rozumiem, jak „6” może być poprawne. W jaki sposób tlen karbonylowy może być $ \ ce {sp ^ 2} $ (1) , a także szybko osiągać równowagę między $ \ ce {sp ^ 3} $ a $ \ ce {sp ^ 2} $ (4)?
Jak już wspomniałem, (4) nie powinno być nawet rozwiązaniem. Przesłanka pytania jest ewidentnie błędna. Proszę, nie traktuj hybrydyzacji zbyt poważnie.
Oto jak doszedłem do następnego punktu. Czy orbitale tlenu w kwasach węglowych są rzeczywiście $ \ ce {sp ^ 2} $ (a nawet $ \ ce {sp ^ 3} $) zhybrydyzowane? Dobrze.
- Często właściwe jest opisanie orbitali tlenu jako $ \ ce {sp ^ 2} $, gdy jest on połączony z dwoma innymi pierwiastkami. Do obligacji potrzebne są dwa płaty $ \ ce {sp ^ 2}, pozostałe $ \ ce {sp ^ 2} $ hosty orbitalne jedna para, pozostałe $ \ ce {p} $ hosty orbitalne druga para.
- Częściej zdarza się, że tlen ma tylko jednego partnera wiążącego. W takich przypadkach bardziej odpowiednie jest opisanie tlenu orbitali $ \ ce {sp} $ ze względu na symetrię. Rozważmy lokalną symetrię, która ma nieskończoną oś obrotu $ C_ \ infty $, stąd muszą istnieć dwa zdegenerowane, prostopadłe orbitale. W większości tych przypadków będziesz mieć również (częściowe) wiązanie π i / lub hiperkoniugację.
- Jest bardzo niewiele wyjątków, takich jak $ \ ce {H3O +} $, gdzie można opisać tlen orbitalami $ \ ce {sp ^ 3} $.
W tym wszystkim należy wziąć pod uwagę, że hybrydyzacja może być ułamkowa. Zobacz ostatnią notatkę tutaj, a bardziej konsekwentnie: „ Co to jest reguła Benta?” i „ Użyteczność reguły Benta - co reguła Benta może wyjaśniać, czego nie mogą inne względy jakościowe? ".
Ważną kwestią do zapamiętania jest to, że gdy istnieje wiązanie π, hybrydyzacja może wynosić maksymalnie $ \ ce {sp ^ 2} $.
Uważam, że odpowiedź 6 tak naprawdę dotyczy błędnej interpretacji stabilizacji rezonansu cząsteczki. (Więcej informacji można znaleźć w artykule Dlaczego potrzebny jest rezonans?)
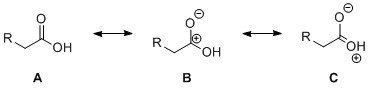
Kwasy węglowe można opisać na poniższym schemacie rezonansowym. Teraz okazuje się, że tlen wykorzystuje orbitale $ \ ce {sp ^ 2} $ w pierwszej strukturze (A) i $ \ ce {sp ^ 3} $ w pozostałych (B, C). Ważne jest, aby zdać sobie sprawę, że sytuacja wiązania w tej cząsteczce jest superpozycją wszystkich (możliwych) struktur rezonansowych. Struktury te nie są w równowadze.
Podsumowując, istnieje kilka problemów z tym pytaniem i możesz chcieć omówić je ze swoim nauczycielem .