Kret jest miarą liczby . Koncepcja „kreta” pomaga nam zważyć lub policzyć określoną liczbę atomów (z wyłączeniem błędów drobnych) za pomocą makroskopowej wagi. Jeśli wiem, że to glukoza i weź 180 gramów (ponieważ C6 H12 O6 ma masę cząsteczkową 180); próbka zawiera 1 mola lub liczby avogadro (N.A) lub 6,023 * 10 ^ 23 cząsteczek glukozy. Podobnie 18 gramów H2O musi zawierać 1 mol lub 6,023 * (10 ^ 23) cząsteczek wody.
Ale jak?
Zacznijmy od kilku makroskopowych obiektów .
Jeśli weźmiemy jedną ciężarówkę pełną cegieł i drugą ciężarówkę pełną wiórów; druga ciężarówka zawierałaby wielokrotnie więcej wiórów cegieł niż cegieł w pierwszej. Proste.
Ale gdybyśmy wzięli 1 cegłę dla ciężarówki (całkowita masa cegieł bardzo ciężka); i 1 wiadro z kawałkami cegieł (całkowita masa zrębków jest znacznie lżejsza niż cegieł pełnych ciężarówek) ... wtedy? Być może oba będą zawierać taką samą (przynajmniej prawie) liczbę cząstek.
Tj. jeśli weźmiemy ciężkie przedmioty w dużych ilościach, a lekkie przedmioty w mniejszych ilościach; liczba obiektów w obu przypadkach byłaby taka sama.
W kategoriach ilościowych:
Powiedz każdy chip = 1 gram. 1 cegła = 1000 gramów.
Jeśli weźmiemy 1234 * 1 gramowe wióry cegieł i 1234 * 1000 gramów cegieł; w obu przypadkach otrzymamy taką samą liczbę cząstek jednostkowych.
Lub jeśli weźmiemy X * 1 gramowe wióry cegieł w jednym miejscu i X * 1000 gramów cegieł w innym miejscu; w obu przypadkach otrzymalibyśmy tę samą liczbę.
Skala molekularna
1 atom wodoru (H) waży 1 rano. 1 cząsteczka glukozy (C6 H12 O6) waży 180 rano. 1 cząsteczka H20 waży 180 rano
Teraz 1 gram = 6,023 * (10 ^ 23) Dalton lub N.A. (*)
Więc tak jak nasz wyżej wspomniany przykład z cegły;
1 gram atomu wodoru (H) (lub NA amu H) lub 180 gramów glukozy (tj. NA * 180 amu glukozy) lub 18 gramów wody (NA * 18 amu wody) zawierałby taką samą liczbę cząstek ( Co jest tutaj 6,023 * (10 ^ 23) sztuk lub sztuk NA ze względu na związek między gramem a amu). W ten sposób 1 mol dowolnej substancji zawierałby liczbę cząsteczek NA
Liczba Avogadro (N.A.) w tym przykładzie działająca tak samo, jak X w poprzednim przykładzie z cegieł.
Oto uproszczony diagram porównujący przykład z życia wzięty z przykładem chemicznym.
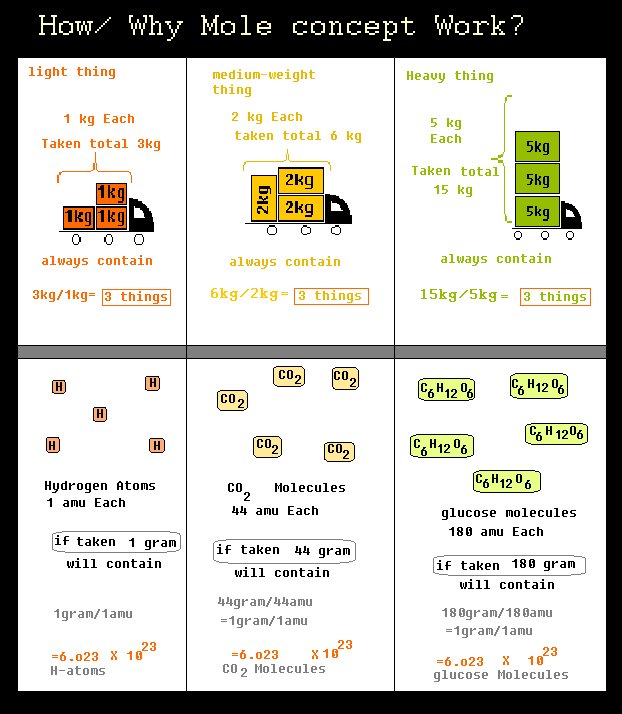
Zaleta
Dostaliśmy
1 C6 H12 O6 + 6 O2 = 6 CO2 + 6 H2O
Liczby po lewej stronie wzoru związku lub współczynnik stechiometryczny; jest najmniejszą możliwą liczbą cząsteczek potrzebnych do zakończenia reakcji.
podano nam pewną ilość glukozy i zapytano nas o ilość CO2 wydzielonego po całkowitym spaleniu w O2?
Możemy to obliczyć na świeżo z przed południem. Większe obliczenia.
Ale koncepcja mola bardzo pomaga, ponieważ możemy określić ilości reagentów i produktów bezpośrednio w gramach, na podstawie wzoru cząsteczkowego i współczynników stechiometrycznych, bez użycia jakiejkolwiek konwersji jednostek między gramem a amu
Gdybyśmy mogli pomnożyć całą reakcję
(180 amu + 6 * 32 amu = 6 * 44 amu + 6 * 18 amu dla odpowiedniego związku)
z NA (można uruchomić numery NA takich reakcji naraz)
i. mi.
180 amu * NA + 6 * 32 amu * NA = 6 * 44 amu * NA + 6 * 18 amu * NA (odpowiedni związek)
lub
1 mol glukozy + 6 moli O2 = 6 moli CO2 + 6 moli H2O.
lub
180 gram + 6 * 32 gram = 6 * 44 gramów + 6 * 18 gramów (odpowiedni związek).
gdy poznaliśmy fakt, zamiast molekuły moglibyśmy użyć mola; i moglibyśmy łatwo napisać reakcję na mole równoległe reakcje. Następnie przeliczamy mole na gram za pomocą wzoru chemicznego, możemy łatwo określić wymaganą lub uzyskaną ilość określonego reagenta lub produktu. Dla określonej wartości 1 reagenta lub produktu
na przykład 2 H2 + O2 = 2 H2O. Z tej reakcji łatwo wywnioskować, że 2 mole H i 1 mol O2 tworzy 2 mole H2O; lub 2 * 2 g H2 i 32 g O2 daje 2 * 18 g H20. Teraz, używając metody jednostkowej, mogliśmy znaleźć żądaną ilość reagenta lub produktu z określonej ilości reagenta lub produktu.
odniesienia:
-
(* ): http://chemistry.bd.psu.edu/jircitano/mole.html
-
Wynik konwersji jednostek Google
-
Stała Avogadro w wikipedii
-
Jednostka masy atomowej w Wikipedii
-
Kret (jednostka) w Wikipedii
-
Masa atomowa w wikipedia
-
Masa cząsteczkowa w wikipedii
-
Masa cząsteczkowa w Wikipedia
-
Czego nas uczono na lekcjach podstawowych chemii