Na początek najważniejsze
Kiedy mówimy o szybkości reakcji, mamy na myśli szybkość, z jaką pojawiają się produkty. Oznacza to, że jest to równe zanikowi reagentów. Tak więc, kiedy określamy ilościowo szybkość w kategoriach reagentów, muszą one mieć przeciwną wielkość. $$ \ text {rate} = \ frac {\ Delta [\ text {produkt}]} {\ Delta t} = - \ frac {\ Delta [\ text {reagent}]} {\ Delta t} $$
Od A do B (i C)
Załóżmy, że uruchamiam reakcję $ \ ce {A ->B + C} $ w dwóch oddzielnych naczyniach, kolba 1 i kolba 2, każda o innym stężeniu $ \ ce {A} $. Powiemy, że kolba 1 jest bardziej skoncentrowana. Jeśli zgadzasz się, że początkowa stawka jest podana jako $ \ text {rate} _ \ mathrm {i} = k [\ ce {A}] _ \ mathrm {i} $, to wynika, że dla każdego początkowego kursu wynosi \ text {rate} _ {i, fl1} = k [\ ce {A}] _ {i, fl1} $ i $ \ text {rate} _ {i, fl2} = k [\ ce {A}] _ {i, fl2}, $ odpowiednio.

Gdybyśmy dodali coś do kolby 2, czy zmieniłoby to szybkość reakcji? Dopóki nie dodamy żadnych $ \ ce {A}, $ kurs będzie taki sam. Stawka zależy od $ \ ce {A} $, ale nic więcej. Więc dodajmy trochę $ \ ce {B} $ i trochę oc $ \ ce {C} $. Dodamy taką samą ilość obu. Nazwijmy tę kwotę $ x $ i ustawmy jako równą różnicy stężeń w $ \ ce {A} $ w dwóch kolbach. $$ x = [\ ce {A}] _ {i, f1} - [\ ce {A}] _ {i.f2} $$ 
Teraz niech reakcja w kolbie 1 będzie przebiegać, aż stężenie $ \ ce {A} $ będzie równe ilości w kolbie 2. Aby odróżnić warunki teraz od warunków początkowych, nazwiemy ten czas $ t = 1 $ (dowolne jednostki). Dzięki stechiometrii reakcji wiemy, że kwota $ \ ce {A} $ i $ \ ce {A} $ będzie wynosić $ \ Delta [\ ce {A}] = [\ ce {A}] _ {i , f1} - [\ ce {A}] _ {i, f2} = x $ Nie ma zauważalnej różnicy między dwiema kolbami, a zatem szybkość reakcji jest taka sama w kolbie 1, jak w kolbie 2. Ponieważ wybraliśmy arbitralne koncentracje, możemy abstrahować to od dowolnej koncentracji. $$ \ text {rate} _ {t = 1, f1} = \ text {rate} _ {i, f2} = k [a \ ce {A}] _ {i, f2} = k [\ ce {A }] $$ 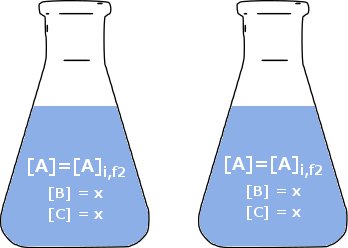
Na koniec chcemy uzyskać natychmiastową stawkę. Robimy to, zmniejszając przedział czasu do nieskończenie małej ilości. $$ \ lim _ {\ Delta t \ to 0} \ frac {- \ Delta [\ ce {A}]} {\ Delta t} = - \ frac {\ mathrm {d} [\ ce {A}]} { \ mathrm {d} t} = k [\ ce {A}] $$