Podstawowa wersja $ \ mathrm {S_N1} $ i $ \ mathrm {S_N2} $ może wystąpić tylko wtedy, gdy istnieje podwójne wiązanie w pobliżu grupy opuszczającej, jak w twoim przykładzie. Narysowałem obie możliwości dla przypadku $ \ mathrm {S_N2} $ w poniższym schemacie.
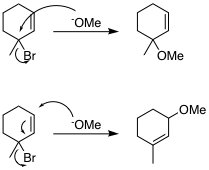
Schemat 1: Porównanie produktów reakcji w ścieżce $ \ mathrm {S_N2} $ (na górze) i $ \ mathrm {S_N2 '} $ (na dole).
Reakcja $ \ mathrm {S_N2} $ jest taka, jak Ty spodziewaj się, że tak będzie. Reakcja $ \ mathrm {S_N2 '} $ wykorzystuje podwójne wiązanie jako system przekaźnika elektronów. Zamiast nukleofila (tutaj: $ \ ce {OMe -} $) bezpośrednio oddziałującego z orbitalem $ \ unicode {x3c3} ^ * (\ ce {C-Br}) $, system π oddziałuje z orbitalem σ *. Następnie nukleofil oddziałuje z LUMO systemu π (odpowiadającym środkowej orbicie układu allilowego π), aby wykonać atak. Ponieważ atak nukleofilowy i grupa opuszczająca znajdują się na różnych atomach węgla, przekazywanych przez system π, nie jest to bezpośredni $ \ mathrm {S_N2} $, ale jego pochodna ($ \ mathrm {S_N2 '} $).
Tę samą logikę można zastosować do $ \ mathrm {S_N1 '} $: tutaj pośrednia karbokacja nie jest zlokalizowaną, ale kationem allilowym.
Wersje zagruntowane są tutaj obserwowane, ponieważ nie tylko bimolekularny atak na silnie podstawiony trzeciorzędowy węgiel ($ \ mathrm {S_N2} $) jest mało prawdopodobny - ten węgiel jest trzeciorzędowy, co zwykle nie oznacza już $ \ mathrm {S_N2} $ - ale także przechwytywanie karbokationu pod $ \ mathrm {S_N1} $ warunki są bardziej prawdopodobne w przypadku atomu węgla o znacznie mniejszych przeszkodach sterycznie.
Dlaczego metanol głównie atakuje zgodnie z mechanizmem typu $ \ mathrm {S_N1} $, podczas gdy metanol jest przeważnie mechanizm $ \ mathrm {S_N2} $ - type Odsyłam cię z powrotem do twojego podręcznika; powody są podawane dość często.