Zastrzeżenie: Teraz uważam, że ta odpowiedź jest całkowicie niepoprawna.
Rozważ cofnięcie głosu za i / lub odrzucenie. Nie lubię widzieć niepoprawnych odpowiedzi pod numerem +22.
Jednak na razie zostawię to. Jest odzwierciedleniem tego, czego naucza się w wielu podręcznikach lub kursach na poziomie licencjackim. Jednak ten konkretny wykres był krytykowany w Shriver & Atkins, a także pomysł, że orbitale 3D mają w jakiś sposób wyższą energię niż orbitale 4s. Wydaje mi się, że wspomniano, że energie zostały obliczone przy użyciu przestarzałego modelu Thomasa – Fermiego – Diraca, ale tak naprawdę nie pamiętam. Zadam jeszcze jedno pytanie dotyczące kwestii 3d vs 4s, ale w międzyczasie wskazałbym czytelnikowi kierunek tych artykułów:
- Pilar, F. L. 4s jest zawsze powyżej 3d! Albo jak odróżnić orbitale od funkcji falowych. J. Chem. Educ. 1978, 55 (1), 2 DOI: 10.1021 / ed055p2.
- Melrose, POSEŁ; Scerri, E. R. Dlaczego orbital 4s jest zajęty przed 3d. J. Chem. Educ. 1996, 73 (6), 498 DOI: 10.1021 / ed073p498.
- Vanquickenborne, LG; Pierloot, K .; Devoghel, D. Metale przejściowe i zasada Aufbau. J. Chem. Educ. 1994, 71 (6), 469 DOI: 10.1021 / ed071p469.
- Scerri, Konfiguracje metalu przejściowego ER i ograniczenia przybliżenia orbity. J. Chem. Educ. 1989, 66 (6), 481 DOI: 10.1021 / ed066p481.
- Krytyka książek Atkinsa autorstwa Erica Scerri.
Chociaż odpowiedź Molly dobrze się spisuje, wyjaśniając, dlaczego elektrony preferencyjnie zajmują podpowłokę 4s nad podpowłoką 3d (ze względu na mniejsze odpychanie między elektronami), nie odpowiada ona bezpośrednio na pytanie, dlaczego kolejność 3d / 4s zmiany energii przechodząc od Ca do Sc. Ukradłem tę figurę od Shrivera & Atkins, wyd. 5:
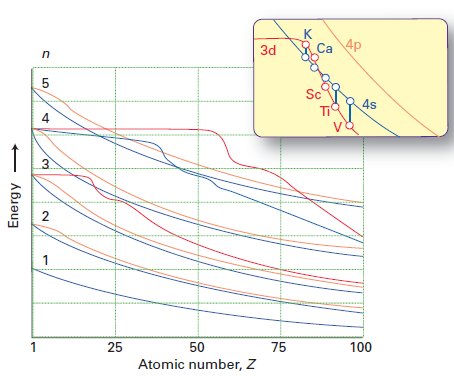
Czerwona linia przedstawia energię orbitalu 3d, a niebieska energię orbitalu 4s. Widać, że do Ca, 3d> 4s, ale dla Sc dalej, 4s < 3d.
Jak słusznie wskazuje chemguide, do Ca orbital 4s ma mniejszą energię niż 3d . Energia elektronu na orbicie jest określona wzorem $$ E = -hcR \ left (\ frac {Z_ \ text {eff}} {n} \ right) ^ 2 $$ gdzie $ hcR $ to zbiór stałych, $ Z_ \ text {eff} $ to efektywny ładunek jądrowy doświadczany przez elektron, a $ n $ to główna liczba kwantowa. Ponieważ $ n = 4 $ dla orbitalu 4 s i $ n = 3 $ dla orbitalu 3D, jeden początkowo oczekiwałby, że orbital 3d będzie miał mniejszą energię (bardziej ujemną energię). Jednak orbital 4s jest bardziej penetrujący niż orbital 3d; można to zobaczyć, porównując funkcje dystrybucji promieniowej dwóch orbitali, zdefiniowane jako $ R (r) ^ 2 r ^ 2 $ , gdzie $ R (r) $ jest radialną funkcją falową otrzymaną z równania Schrodingera:
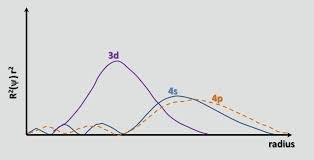
Orbital 4s ma mały wewnętrzny płat promieniowy (niebieskie wybrzuszenie po lewej stronie wykresu), co oznacza, że elektron 4s ma tendencję do spędzania czasu w pobliżu jądra, powodując, że doświadcza pełnego jądra w większym stopniu. Mówimy, że elektron 4s lepiej penetruje elektrony rdzenia (tj. 1s przez podpowłoki 3p). Dlatego ekranowany jest mniej niż elektron w 3D, co powoduje, że $ Z_ \ text {eff} $ jest większy. Przechodząc z orbity 3 s do 4 s, wzrost $ Z_ \ text {eff} $ wygrywa nieznacznie w porównaniu ze wzrostem $ n $ , co obniża energię orbity 4s.
Przejście z Ca do Sc oznacza, że dodajesz jeszcze jeden proton do jądra. To sprawia, że ładunek jądrowy jest większy, a zatem zarówno orbitale 4s, jak i 3d są ustabilizowane (ich energia spada). Problem polega na tym, że energia orbitalu 4s spada wolniej niż orbitalu 3d, ponieważ orbital 4s jest względnie rozproszony promieniowo (maksimum w funkcji rozkładu radialnego występuje przy większej wartości $ r $ ). Jeśli studiowałeś fizykę, możesz myśleć o niej jako o interakcji między dwoma ładunkami punktowymi; jeśli odległość między nimi jest duża, to zwiększenie wielkości jednego ładunku punktowego ma mniejszy wpływ na energię potencjalną $ U = - \ frac {kq_1q_2} {r} $ span >. Szybszy spadek energii 3D ma również sens, ponieważ gdyby ładunek jądrowy dążył do nieskończoności, ekranowanie stałoby się nieistotne; energie orbity byłyby wtedy całkowicie zdeterminowane przez $ n $ , a gdyby tak było, można by oczekiwać 3d < 4s pod względem energii, jak powiedzieliśmy na samym początku.
Jednak w Sc elektrony preferencyjnie zajmują podpowłokę 4s, mimo że ma ona wyższą energię, a dzieje się tak również dlatego, że orbital 4s jest rozproszony promieniowo - elektrony mają więcej „przestrzeni osobistej” i są mniej odpychające. Jednym ze sposobów wyrażenia tego jest to, że pusty orbital 4s w Sc ma wyższą energię niż pusty orbital 3d, ale wypełniony orbital 4s ma niższa energia niż wypełniona orbital 3d. Fakt, że 4s> 3d w energii wyjaśnia również, dlaczego w przypadku metali przejściowych elektrony 4s są usuwane jako pierwsze po jonizacji ( $ \ ce {Sc ^ +}: [\ ce {Ar }] (3 \ mathrm {d}) ^ 1 (4 \ mathrm {s}) ^ 1 $ .)
Chciałbym tylko zakończyć komentarzem, że czynniki określające konfiguracje elektroniczne elementów bloku d i bloku f są w rzeczywistości bardzo ściśle zrównoważone i tylko niewielka zmiana jednego czynnika może prowadzić do zupełnie innej konfiguracji elektronicznej. To dlatego Cr i Cu mają „anomalną” konfigurację, która maksymalizuje energię wymiany, podczas gdy węgiel nie otrzymujemy przyjmując $ (1 \ mathrm {s}) ^ 2 (2 \ mathrm {s}) ^ 1 (2 \ mathrm {p}) ^ 3 $ konfiguracja w celu uzyskania „stabilnych, w połowie wypełnionych powłok”.