Kiedy kryształ zostanie umieszczony w rozpuszczalniku, cząsteczki / jony w krysztale ulegają dysocjacji i są solwatowane przez rozpuszczalnik. Proces zatrzymuje się, gdy jest równowaga między kryształem a roztworem cząsteczek / jonów i rozpuszczalnika. W tym momencie roztwór jest nasycony, ale tylko wtedy, gdy w kontakcie z roztworem nadal obecne jest ciało stałe. W tym momencie darmowa energia jest minimalna.
Niektóre cząsteczki / jony zawsze będą dysocjować od kryształu z powodu wzrostu entropii przez rozcieńczenie lub zmieszanie z rozpuszczalnikiem. Rozpuszczalność zależy zatem od tego, czy te cząsteczki / jony są bardziej stabilne w rozpuszczalniku niż w krysztale.
(Procesy te nie wskazują, jak szybko kryształ się rozpuści. To zależy od bariery energii aktywacji, aby opuścić kryształ i wejść do roztworu, a nie od względnych energii kryształu i solwatowanych cząsteczek / jonów).
W krysztale jonowym jony są utrzymywane razem przez siły kulombowskie, które mają duży zasięg i zależą od odległości 1 $ / r. Aby określić dokładną energię wiązania w krysztale, należy wziąć pod uwagę wszystkie interakcje z innymi jonami, a nie tylko najbliższymi sąsiadami. Jest to standardowe obliczenie, którego najtrudniejsza część polega na znalezieniu stałej Madelunga dla konkretnego kryształu.
Na powierzchni kryształu oddziaływania są znacznie mniejsze niż w masie, ponieważ te cząsteczki / jony są w kontakcie tylko z połową jonów kryształu, a także oddziałują z rozpuszczalnikiem. Aby oszacować rozpuszczalność, oblicza się energię Coulomba rozdzielenia dwóch jonów na odległość r w rozpuszczalniku o stałej dielektrycznej (przenikalności względnej) $ \ epsilon $. Ta energia wynosi $$ w = \ frac {z_1z_2e ^ 2} {4 \ pi \ epsilon_0 \ epsilon r} $$
gdzie $ \ epsilon _0 $ to przenikalność wolnej przestrzeni, e ładunek elektroniczny, a $ z_i $ ładunek jonu i i energia w $ r = \ infty $ przyjmuje się, że wynosi zero.
Prawo Coulomba nie jest tak naprawdę ważne przy małych odległościach, ponieważ molekularność ośrodka sprawia, że założenie kontinuum w zakresie stałej dielektrycznej ulega załamaniu. Niemniej jednak daje wgląd, choć zbliżony do solwatacji.
Wolna energia do rozdzielenia dwóch jonów o promieniach $ r _ + $ i $ r _- $ wynosi zatem $$ \ Delta \ mu \ ok \ frac {+ z_1z_2e ^ 2} {4 \ pi \ epsilon_0 \ epsilon (r_ + + r _-)} $$, która jest dodatnia, ponieważ interakcja kulombowska zawsze będzie ujemna przy łączeniu przeciwnych ładunków.
Rozkład Boltzmanna dla stężenia X_1 $ i X_2 $ w dwóch częściach -istniejące fazy to $$ X_1 = X_2exp (- \ frac {(\ mu_1- \ mu_2)} {k_BT}) = X_2exp (- \ frac {\ Delta \ mu} {k_BT}) $$ Jeśli skojarzymy stężenie $ X $ jako ułamek molowy, to może być miarą rozpuszczalności, $ X_s $, więc $$ X_s \ ok exp (- \ frac {(\ Delta \ mu} {k_BT}) = exp [- \ frac {e ^ 2} {4 \ pi \ epsilon_0 \ epsilon k_BT} \ frac {1} {(r_1 + r_2)}] $$
W wodzie rozpuszczalność ułamka molowego NaCl wynosi 0,11 $, czyli jest większa niż obliczone $ X_s = 0,08 $, ale niewiele biorąc pod uwagę prostotę modelu.
Ostatnie równanie ma postać ogólną $$ X_s = exp (-C / \ epsilon) $$, gdzie $ C $ jest stałą zależną od par jonowych i temperatury, stąd wykres logarytmu rozpuszczalność (jako ułamek molowy) w funkcji odwrotności stałej dielektrycznej dla tych samych par jonowych w różnych rozpuszczalnikach powinna dać linię prostą. Poniższy wykres przedstawia dane dla NaCl w różnych rozpuszczalnikach, potwierdzona jest przybliżona zależność. Ze względu na odwrotność promieni jonowych w równaniu większe jony powinny być ogólnie lepiej rozpuszczalne niż mniejsze.
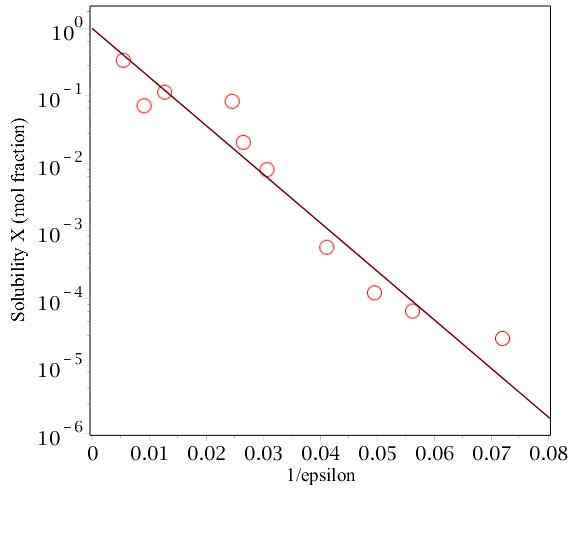
Rozpuszczalniki ($ \ epsilon $) od lewej do prawej to metyloformamid (182,4), formamid (109,5), woda (78,5), glikol etylenowy (40,7), etanoloamina (37,72), metanol (32,6), etanol ( 24,3), propanol (20,2), butanol (17,8), pentanol (13,9). (Dane zaadaptowane z J. Israelachvilli, Intermolecular and Surface Forces).
Ogromny zakres rozpuszczalności jest dość dramatyczny i pokazuje, że główny wpływ na rozpuszczalność ma stała dielektryczna rozpuszczalnika $ \ epsilon $. Możesz to docenić na podstawie prawa Coulomba. Pole elektryczne wokół jonu jest skutecznie „wygaszane” w wysokim dielektryku, co oznacza, że energia interakcji gwałtownie spada wraz z odległością. W ten sposób jon skutecznie izoluje się od wszystkich innych i jest otoczony jedynie dipolami rozpuszczalnika. W niskim dielektryku pole elektryczne jonu rozprzestrzenia się na znacznie większą odległość (w stosunku stałych dielektrycznych, które mogą być 20 razy większe), w ten sposób jeden jon może `` odczuwać '' działanie innych znajdujących się w pobliżu, gdy dyfundują blisko i jeśli są przyciągane, mogą łączyć się, tworząc cząsteczkę jonową, a zatem nie są już rozpuszczalne.
Na rysunku wszystkie te rozpuszczalniki są raczej podobne, a rozpuszczalniki wiążące wodorowe w większym lub mniejszym stopniu. Wydaje się, że rozpuszczalniki niezwiązane wodorem są mniej skuteczne w solwatowaniu związków jonowych, na przykład rozpuszczalność NaCl w acetonie ($ \ epsilon = 20,7 $) jest $ X_s = 10 ^ {- 7} $ znacznie mniejsza niż w przypadku propanolu o podobnym $ \ epsilon $