Ok, spójrzmy na tę strukturę. Narysowałem / obliczyłem (B3LYP / 6-31G) model 3D tej konstrukcji i zoptymalizowałem geometrię.
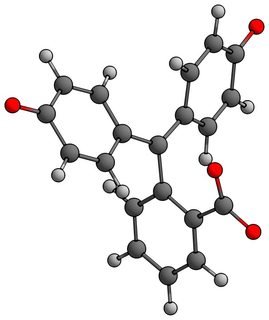
I co z tego czy tu widzimy? Właściwie nie ma dwóch pierścieni w jednej płaszczyźnie, ale dwa są prawie płaskie (~ 40 ° skręcenia), podczas gdy jeden jest w zasadzie skręcony o 90 °. Przyjrzyjmy się najpierw tej z grupą karboksylową, która jest bardzo skręcona. Grupa karboksylowa jest w pozycji orto. Jeśli przekręcimy pierścień, aby znalazł się w płaszczyźnie z jednym z pozostałych pierścieni, tlen zderzy się z grupą CH. Węgle i tlenki są dość duże, więc odpychanie między nimi jest, a kąt musi być dość duży, aby to zadziałało. Oto obraz zderzających się grup (umieściłem to pod pewnym kątem, ponieważ jest łatwiejsze do zobaczenia), pamiętaj, że ta reprezentacja atomów nie jest prawdą. Otaczająca je „chmura” elektronów jest w rzeczywistości znacznie większa.
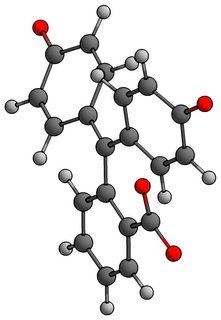
Dlaczego pozostałe dwa pierścienie mają kąt około 40 ° między nimi? Jeśli są płaskie, mogą mieć korzystną koniugację. Co się stanie, jeśli umieścimy je w jednej płaszczyźnie?

Możesz zobaczyć, że dwa wodory na górze zbliżają się bardzo blisko. W rzeczywistości zbyt blisko. Są więc dwa sposoby, aby tego uniknąć. Przekręć dwa pierścienie lub zwiększ kąt wokół centralnego atomu węgla między pierścieniami. W przypadku węgla sp2, takiego jak tutaj, optymalną wartością byłoby 120 °, moglibyśmy ją zwiększyć, powiedzmy o 145 stopni:
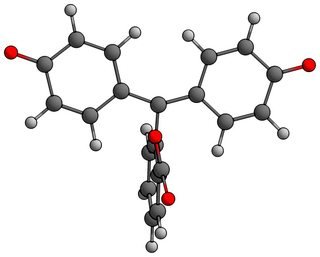
Teraz wodory nie będą już ze sobą kolidować, ale okazuje się, że kosztuje to znacznie więcej energii niż stracilibyśmy, gdybyśmy skręcili dwa pierścienie, aby uniknąć zderzenia się wodorów. Na końcu ten kąt staje się nieco większy (~ 124 ° zamiast 120) i otrzymujemy skręt między pierścieniami aromatycznymi, który jest wciąż wystarczająco niski, aby uzyskać dobrą koniugację między nimi (patrz pierwsza struktura). >