Krótkie podsumowanie
publikacja w linku (z 1975 r.) jest prawdopodobnie błędna . Nieco nowsza praca ( J. Am. Chem. Soc., 1989, 111 (21), str. 8112-8115) sugeruje, że długości wiązań są prawie równe. Niektóre szybkie obliczenia (poniżej) przy użyciu wielu nowoczesnych metod sugerują, że zgodnie z oczekiwaniami długość obligacji CS w $ \ ce {CH2SH -} $ jest krótsza niż w $ \ ce {CH3SH} $.
W przypadku obu starszych prac wyniki obliczeń (przy użyciu podstawowego Hartree Focka) byłyby uważane za wysoce podejrzane w świetle współczesnej recenzji, ponieważ wiadomo, że Hartree Fock ma problemy z anionami. Z pewnością artykuł z 1975 roku nawet nie wspomina o zestawie podstawowym.
Jak widać poniżej, jest jasne, że wyniki zależą od metody, ale najlepsze metody, z rozsądnymi zestawami podstawowymi wskazują, że długość wiązania jest przynajmniej nieco krótsza z powodu częściowego znaku podwójnego wiązania.
Więcej szczegółów
Pierwszą rzeczą do rozważenia jest to, że to dwie formy $ \ ce {CH2SH -} $, syn i anti , oparte na orientacji anionu formalnie związanego z C i grupy SH:
formularz synchronizacji
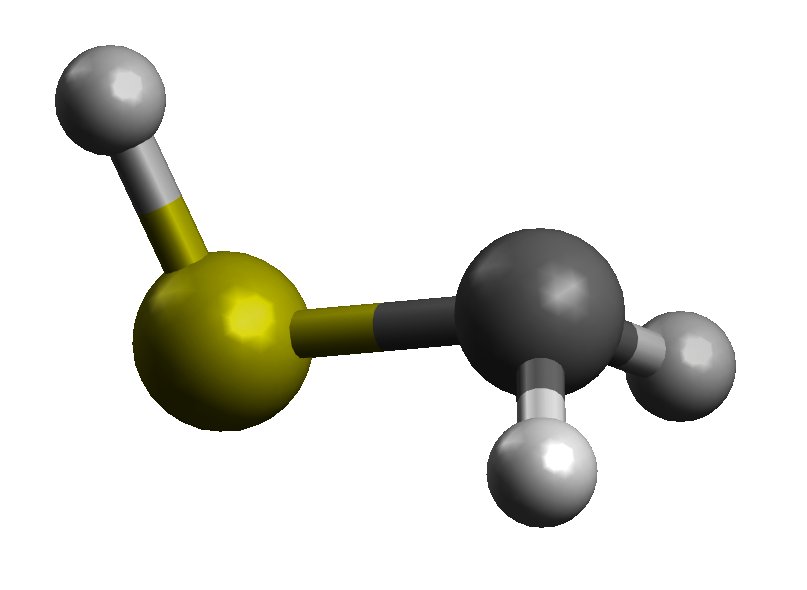
formularz anty
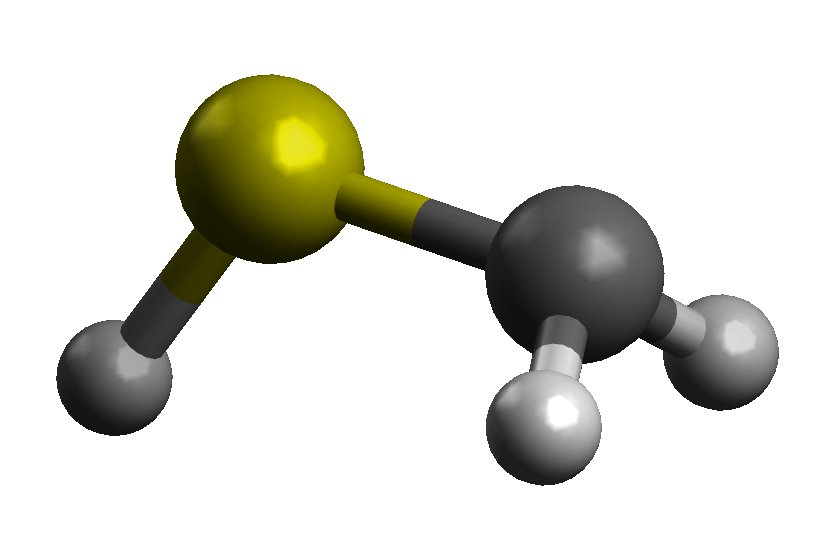
Będą one miały różne długości wiązań, ponieważ forma anty będzie miała wkład struktur rezonansowych II i III z odpowiedzi Rona . Daje to charakter podwójnego wiązania i prawdopodobnie powinno mieć krótsze wiązanie, chociaż można również wywołać odpychanie elektrostatyczne.
Forma syn nie będzie miała wyraźnego efektu, ponieważ Wolna para anionów C i samotna para S znajdują się po przeciwnej stronie wiązania. Domyślam się, że długość obligacji jest mniej więcej taka sama jak $ \ ce {CH3SH} $.
Myślę, że jasne przesłanie jest takie, że możemy wyjaśnić wiele rzeczy, ale lepiej jest wiedzieć, czy nasze wyniki są dokładne, zanim spróbujesz je wyjaśnić.
W przypadku bardziej nowoczesnych metod obliczeniowych widzę, że forma syn ma podobną długość wiązania CS do $ \ ce {CH3SH} $, a forma anti jest nieco krótsza . Podejrzewam, że poprzedni wynik jest po prostu błędny . Obliczenia dotyczące anionów są trudne, ponieważ dodatkowy elektron jest zwykle silnie rozproszony. Spodziewam się, że podstawa była po prostu niewystarczająca.
Różnica energii między dwiema formami wynosi ~ 1 kcal / mol, więc eksperymentalnie będą one łatwo przekształcać się wzajemnie i można będzie zaobserwować średnią długość wiązania. Jak wspomniano w komentarzach, gatunek ten byłby prawdopodobnie trudny do zaobserwowania, nawet w fazie gazowej, ponieważ $ \ ce {CH3S -} $ jest bardziej stabilny.
Obliczone długości wiązań CS (w Å):
Dla wszystkich metod pełną optymalizację geometrii przeprowadzono za pomocą wskazanych metod. Uznałbym obliczenia CCSD za wysokiej jakości.